- Detalles
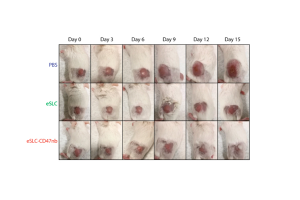
Tras colonizar el tumor liberan un anticuerpo terapéutico, potencian la inmunidad natural y evitan la formación de metástasis.
Científicos de la Universidad de Columbia han modificado genéticamente una cepa no patogénica de Escherichia coli, proporcionando a esta bacteria la capacidad de colonizar diversos tipos de tumores humanos, inducir su propia lisis y liberar un nanocuerpo antagonista del CD47, un marcador comúnmente sobreexpresado en las células cancerosas.
En experimentos con animales portadores de tumores singénicos los investigadores constataron que la bacteria promueve la activación de los linfocitos T infiltradores del tumor, la regresión del mismo y la prevención de la formación de metástasis, además de prolongar la supervivencia. Sreyan Chowdhury, co-director del estudio, afirma que la inyección local de la bacteria también estimuló respuestas inmunitarias específicas de antígenos tumorales, lo que resulta en un efecto abscopal consistente en la reducción del crecimiento de tumores no tratados en el mismo animal. Esto constituiría prueba de concepto de que las bacterias modificadas genéticamente son seguras y pueden ser usadas localmente para proporcionar inmunidad antitumoral sistémica, asevera Chowdhury.
- Detalles
El hallazgo, que sugiere un abordaje metabólico-psicológico de esta enfermedad altamente letal, abre la puerta a desarrollar medicamentos para su tratamiento que actualmente no existen.
Investigadores del CIBEROBN pertenecientes al Consorcio y grupo de trabajo internacional de Trastornos de la Alimentación y del Consorcio de Psiquiátrica Genética identifican ocho marcadores genéticos en casi 17.000 casos de anorexia nerviosa y pudieron realizar un análisis más preciso de la arquitectura genética del trastorno. Encontraron además que esta patología tiene correlaciones genéticas con ciertos trastornos psiquiátricos, como el trastorno obsesivo compulsivo y el trastorno depresivo mayor, así como la actividad física, Obesidad y otros rasgos metabólicos.
Fernando Fernández-Aranda y Susana Jiménez-Murcia, del Instituto de Investigación Biomédica de Bellvitge (IDIBELL) y del grupo de Trastornos de la Conducta Alimentaria del Hospital Universitario Bellvitge (HUB), forman parte de esta iniciativa de gran alcance en la que colaboran más de 180 especialistas que forman parte de más de 154 centros e instituciones de investigación de todo el mundo. El análisis, el mayor informe sobre asociación de genoma realizado sobre esta enfermedad hasta el momento, acaba de publicarse en la prestigiosa revista científica Nature Genetics.
- Detalles
Los investigadores han conseguido generar un modelo de ratón que reproduce la sintomatología básica del síndrome de Bosch-Boonstra-Schaaf, una enfermedad rara neurodegenerativa en la que se asocia atrofia del nervio óptico con discapacidad intelectual.
El síndrome de Bosch-Boonstra-Schaaf es una enfermedad rara neurodegenerativa en la que se asocia atrofia del nervio óptico con discapacidad intelectual. Un estudio munticéntrico ha conseguido generar un modelo de ratón que recrea esta enfermedad originada por una mutación en el gen NR2F1 y, por tanto, ha permitido descifrar la sintomatología básica de la atrofia del nervio óptico y la consiguiente pérdida de la función visual de los pacientes. Además, propone un posible enfoque terapéutico que podría aplicarse a otras neuropatías ópticas de tipo genético.
Este trabajo es portada de la prestigiosa revista EMBO Molecular Medicine y, dado su interés, ha recibido un comentario de los editores. En el estudio, coordinado por el equipo del Inserm francés que lidera Michèle Studer en el Instituto de Biología de Valrose, ha participado el grupo de investigación liderado por Paola Bovolenta en el Centro de Biología Molecular `Severo Ochoa´ (CSIC-UAM) y el Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER) y un equipo de la Universidad Pablo de Olavide de Sevilla.
- Detalles
Un equipo de investigadores, liderado por el Prof. Juan Carlos Izpisúa y Pedro Guillén, halla nuevas funciones de la proteína DGCR8, clave para aliviar enfermedades como la artrosis.
Científicos españoles del Instituto Salk de California y la Clínica CEMTRO de Madrid, liderados por el Prof. Juan Carlos Izpisúa y Pedro Guillén, han descubierto una nueva función de la proteína DGCR8, que contribuye significativamente al rejuvenecimiento de las células mesenquimales adultas y permite regenerar más eficazmente los huesos y cartílagos, así como ayudar a reducir la inflamación de un músculo.
La investigación, que ha sido posible gracias a una combinación de tecnologías de última generación, pone de manifiesto que se trata de un tratamiento seguro, que podría ayudar a contrarrestar declives fisiológicos relacionados con la edad, como la artrosis, al prevenir o revertir el daño en la heterocromatina.